41
ОБЗОРНЫЕ СТАТЬИ
УДК: 616.31-002.157.1-036.12-02-092
АКТУАЛЬНОСТЬ ЭТИОЛОГИИ И
ПАТОГЕНЕЗА ХРОНИЧЕСКОГО
РЕЦИДИВИРУЮЩЕГО
АФТОЗНОГО СТОМАТИТА
(ОБЗОР)
Хасанова Л.Э., Ахмедов А.А.
Ташкентский государственный
стоматологический институт
Хронический рецидивирующий афтозный стоматит
(ХРАС) представляет серьезную проблему в связи со
сложностью патогенетических механизмов развития,
системностью поражения организма, сложностью ве
-
дения пациентов. Иммунологические изменения, на
-
блюдаемые у пациентов с ХРАС, в целом представляют
собой традиционную динамику реализации мукозаль
-
ного клеточно-опосредованного иммунного ответа, во
многом являются реактивными для афт, недостаточно
обоснованы как этиологически значимые. На совре
-
менном этапе существует большое количество средств
и методов лечения ХРАС, однако полный алгоритм ком
-
плексной терапии не разработан, отсутствуют методи
-
ки поддерживающей терапии, что требует дальнейших
исследований.
Ключевые слова:
хронический рецидивирующий
афтозный стоматит, патогенетические механизиы, кле
-
точно-опосредованный иммунный ответ, комплексное
лечение.
Annotation
Any common mechanisms for RAS and gastrointestinal
diseases are not proposed in publications, that is why, last-
mention may be predisposes factors. Previous studies at
RAS, in principle, have suggested cell-mediated activation
of immune response – common for mucosa, they have
pathogenetic and reactive meaning, but it is early to interpret
that as an etiology. Various treatment modalities are used,
but no therapy is definitive at RAS. Systemic medications
can be tried if topical therapy is ineffective. Ethiology and
pathogenesis of recurrent aphthous stomatitis still actually.
Key words:
recurrent aphthous stomatitis, mucosal
immunity, etiology, pathogenesis, therapy.
Хронический рецидивирующий афтозный стоматит
(ХРАС) представляет серьезную проблему в связи со
сложностью патогенетических механизмов развития,
системностью поражения организма, сложностью ве
-
дения пациентов. По данным других авторов и ВОЗ,
распространенность ХРАС среди населения составля
-
ет 10-20%, чаще всего это заболевание встречается у
школьников и подростков; с возрастом частота ХРАС
нарастает [30]. Согласно классификация заболеваний
слизистой оболочки полости рта (СОПР) Т.Ф. Виногра
-
довой (1987), ХРАС (с 2008 года диагноз рецидивирую
-
щая афта) относится к заболеваниям преимущественно
аллергической природы с возможными аутоиммунны
-
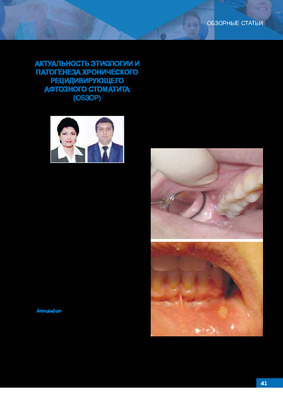
Рис. 1, 2. Пациентка К. Рецидивирующий афтозный стоматит,
язвенная форма локализация патологического элемента на
слизистой оболочке переходной складки верхней челюсти,
в области зуба 1.7, локализация патологического элемента
на слизистой оболочке нижней губы.

42
STOMATOLOGIYA
ми механизмами. ХРАС проявляется образованием
эрозий, окантованных яркой полоской гиперемии, или
язвенных элементов поражения в области переходных
складок, дна, щек, губ, слизистой оболочки полости рта
(СОПР) (рис. 1, 2), с вовлечением регионарных лимфо
-
узлов.
Легкая степень тяжести ХРАС характеризуется воз
-
никновением рецидивов один раз в несколько лет, при
среднетяжелой форме рецидивы наблюдаются 1-3 раза
в год, при тяжелой форме – более 4-х раз в год и/или
появление элементов более глубокого поражения сли
-
зистой – язв [2]. Проблема комплексного подхода к
терапии ХРАС с участием врачей-стоматологов, тера
-
певтов, гастроэнтерологов и др., выработка алгоритма
поддерживающей терапии с целью предотвращения
рецидивов заболевания остается актуальной проблемой
современной медицины.
Невысокая распространенность тяжелых форм
ХРАС, достаточно быстрая инволюция элементов пора
-
жения даже при паллиативном лечении объясняют до
-
вольно медленное развитие и углубление нашего пони
-
мания этиопатогенеза, о чем свидетельствуют давность
публикаций и многообразие факторов возникновения
ХРАС. При этом точное определение этиологии отсут
-
ствует. Сегодня среди потенциальных этиопатогенети
-
ческих факторов ХРАС публикации отмечают систем
-
ные заболевания ЖКТ, дефицит В
12
, иммунологические,
генетические и локальные микробные механизмы.
Целью обзора является анализ направлений решения
вопроса этиопатогенеза и лечения ХРАС в зарубежных
публикациях для обоснования актуальности этой про
-
блемы.
Согласно одной из точек зрения на этиопатогенез
ХРАС, это заболевание является одним из симптомов
различных заболеваний ЖКТ. Тем не менее, не все забо
-
левания ЖКТ и не всегда проявляются таким образом.
Недавнее исследование с целью проведения корреля
-
ции между ХРАС и диспепсиями, наличием инфекции
Helicobacter pylori, иммунологическими отклонениями,
анемиями показало, что чаще всего ХРАС наблюдается
при диспепсиях [12,20].
Следующая широко известная точка зрения состоит
в том, что дефицит В
12
, а также желeза и фолиевой кис
-
лоты может быть этиологией ХРАС [9,14,34]. По дан
-
ным I. Volkov (1996), в случаях выявления В
12
-дефицита
у пациентов с ХРАС использование В
12
-терапии приво
-
дило к быстрому выздоровлению и довольно стойкой
ремиссии. Но есть также данные, подтверждающие, что
дефицит В
12
четко ассоциирован с глосситом, атрофи
-
ческим гастритом и анемией и при этом не всегда со
-
провождается ХРАС [28,35,38]
Общий механизм или звено патогенеза для забо
-
леваний ЖКТ и афт на СОПР не получило должного
освещения в литературе. Также нет данных, которые
показывали бы похожие элементы поражения ЖКТ и
СОПР при ХРАС. Выявляемая статистически досто
-
верная ассоциация ХРАС с заболеваниями ЖКТ сви
-
детельствует о том, что заболевания ЖКТ могут быть
предрасполагающим, но не этиологическим фактором
возникновения ХРАС. Механизм же, объединяющий
дефицит В
12
, фолиевой кислоты и заболевания ЖКТ,
довольно прост, хотя и принято эти факторы рассма
-
тривать несколько изолированно друг от друга. Тем не
менее, витамин В
12
поступает в организм человека из
пищи животного происхождения, а его абсорбция зави
-
сит от соответствующей кислотности желудка, а также
от состояния тонкого кишечника, поскольку участки аб
-
сорбции специфичны. Вегетарианцы и пожилые люди
имеют риск развития приобретенной формы дефицита
В
12
. Длительно существующий дефицит В
12
ведет к де
-
фициту метаболически тесно связанной с ним фолие
-
вой кислоты, а клинически, помимо первичной мега
-
лобластной анемии и нейрологических расстройств, к
сосудистым заболеваниям и, по принципу «порочного
круга», к заболеваниям ЖКТ [31].
Одна из распространенной теорией – возникнове
-
ние ХРАС вследствие особенностей состава и взаимо
-
действия микрофлоры полости рта. Точная корреляция
ХРАС с определенным инфекционным агентом полости
рта затруднена наличием многочисленных и разноо
-
бразных по составу комплексов микрофлоры при ХРАС.
Недавнее исследование Marchini L. и соавт. (2007), про
-
веденное методом полимеразной цепной реакции на
базе лаборатории молекулярной генетики и геномики,
установило, что из общего числа исследованных 535
клонов 95 видов микроорганизмов после сравнения с
банком ДНК в образцах пациентов с ХРАС было выяв
-
лено 57 филотипов, 11 из которых – известные виды. У
пациентов контрольной группы пациентов имелось 38
филотипов, пять из которых известны. Только три вида
филотипов были представлены в изобилии в обеих груп
-
пах: Gemella haemolysans, Streptococcus mitis штамм
209 и Streptococcus pneumoniae R6. И только ген микро
-
организма Prevotella присутствовал исключительно при
ХРАС, но составлял 16% от общего количества клонов,
выявленных в очагах поражения [26]. Авторы отмеча
-
ют, что их находки подтверждают возможность отли
-
чия в составе микрофлоры при ХРАС и необходимость
дальнейших количественных и качественных анализов
бактерий, ассоциированных с СОПР. По сути, измене
-
ния в составе микрофлоры могут быть отображением
ХРАС, как и в принципе любого воспаления в полости
рта, но не специфической причиной ХРАС
Получение сведений об истинной этиологии ХРАС
затруднено также из-за рецидивирующего характера
ХРАС, поэтому термин «полиэтиологичность» ХРАС
в большей степени характеризует причины рецидивов.
Пусковые механизмы рецидивов ХРАС отличаются
у разных подгрупп пациентов. К ним относят стресс,
травмы, химические раздражители, особенности пи
-
тания, гормональные сдвиги, инфекции. Примером
взаимосвязи перечисленных факторов служит воз
-
растающий уровень тревожности при возникновении
элементов поражения при ХРАС, который ведет к ме
-

43
ОБЗОРНЫЕ СТАТЬИ
таболическим и гормональным изменениям, в частно
-
сти к возрастанию уровня кортизола в крови, что имеет
один из наиболее главных психологических эффектов.
Стресс может вызывать изменения поведения челове
-
ка, например, травмирующее закусывание щек, губ,
сухость во рту, что провоцирует ХРАС. Достоверное
повышение концентрации кортизола в ротовой жидко
-
сти и крови пациентов с ХРАС установлено, поэтому
влияние стресса на рецидивирование ХРАС довольно
обоснованно [5].
Иммунопатогенетические механизмы ХРАС могут
быть общим звеном для главных пусковых факторов
рецидивов афт: стресса, травмы, химических раздра
-
жителей, гормональных сдвигов, особенностей пищи и
наследственности. Анализ сведений о роли иммунных
процессов при ХРАС показал, что такие предположения
были сделаны довольно давно. На сегодня у пациентов
с ХРАС охарактеризован процесс иммунного ответа на
экзогенные стимулы и обычные микроорганизмы рото
-
вой полости как клеточно-опосредованный, направлен
-
ный на группы эпителиоцитов.
Ранние иммунологические исследования пери
-
ферической крови показали повышение количества
CD4+ИЛ-2R+ и CD8+ИЛ-2R+ активированных Т-кле
-
ток и повышение с последующим снижением имму
-
норегуляторного индекса (соотношение CD4+/CD8+)
у пациентов с ХРАС в динамике появления афт, что
отображает реализацию клеточно-опосредованно
-
го иммунного ответа [43]. Уменьшение количества
CD4+-клеток в крови и повышение уровня CD8+ у па
-
циентов с ХРАС единогласно отмечают практически все
исследователи [37]. Затем было установлено, что это
может происходить за счет уменьшения пропорции ре
-
гуляторных Т-клеток (Трег), которые являются субпо
-
пуляцией СD4+-клеток. Роль Трег в норме заключается
в подавлении пролиферации и эффекторных функций
других иммунных клеток, что обусловливает их ключе
-
вую роль в регуляции иммунного ответа.
Дальнейшие исследования P. Lewkowicz и соавт.
(2008) выявили более глубокую дисфункцию со сто
-
роны субпопуляции Трег [30]. Так, функциональные
характеристики Трег у пациентов с ХРАС свидетель
-
ствуют о том, что их способность ингибировать проли
-
ферацию и продукцию цитокинов других СD4+-клеток
достоверно снижена примерно в два раза по сравнению
с аналогичными клетками здоровых доноров. Кроме
того, снижение экспрессии мРНК индолеамин-2,3-ди
-
оксигеназы (IDO – фермент, участвующий в проти
-
вовоспалительной сигнализации) в неповрежденной
СОПР пациентов с ХРАС также может вносить вклад в
утрату локальной иммунной толерантности.
Как сообщалось ранее, при ХРАС были проанали
-
зированы уровни цитокинов в сыворотке крови, дис
-
баланс которых связан с воспалением. Тем не менее,
источниками этих цитокинов могут быть как лимфо
-
идные, так и нелимфоидные клетки. Развитие методов
внутриклеточного определения цитокинов при помощи
проточной цитометрии сделало возможным исследо
-
вание вклада каждой конкретной клетки в специфи
-
ческую продукцию цитокинов. J. Freysdottir и соавт.
(1999) продемонстрировали, что у пациентов с ХРАС
повышенная пропорция γδ-Т-клеток секретирует повы
-
шенные же уровни ИНФ-γ [35].
Таким образом, клетки, продуцирующие тип цитоки
-
нов Тх1 – и αβ- и γδ-типов, присутствуют у пациентов
с ХРАС. Эти клетки могут играть специфическую роль
в процессе развития изъязвлений СОПР либо активиро
-
ваться как результат воспалительного ответа.
Противоречивы данные относительно роли в патоге
-
незе ХРАС и вообще наличия циркулирующих иммун
-
ных комплексов (ЦИК) у пациентов с ХРАС: J. Bagg
и соавт. (1987) не выявили ЦИК с IgG, а также откло
-
нений содержания в крови IgM [8]. Но другие авторы
считают, что локальный «...васкулит предшествует воз
-
никновению лимфоцитарного инфильтрата вокруг афт
и возникает за счет отложений иммунных комплексов,
которые образуют, предположительно, аутоантитела к
компонентам СОПР» (что, впрочем, показано только
морфологически) [32]. Без выявления специфических
аутоантигенов и, соответственно, аутоантител в составе
иммунных комплексов вопрос об аутоиммунном меха
-
низме ХРАС является, по сути, гипотезой.
В заключение обсуждения вопроса об иммунных
механизмах патогенеза ХРАС необходимо отметить:
вполне закономерным является то, что непосредствен
-
но в СОПР отображением динамики иммунного ответа
служат уровни цитокинов и иммунные клетки. Клеточ
-
но-опосредованный иммунный ответ является обыч
-
ным нормальным иммунным ответом для всех слизи
-
стых. Так, согласно основополагающим принципам
работы иммунной системы, инфицированные, стресси
-
рованные или поврежденные другим образом эпители
-
оциты распознаются по изменению уровня экспрессии
молекул ГКГС І класса и презентованным антигенам
цитотоксическими и/или другими киллерными лимфо
-
цитами и подвергаются киллингу. Нам не удалось най
-
ти ответ на вопрос, что же является причиной запуска
каскадов иммунных сдвигов и реакций в определенных
участках эпителия. Но косвенные свидетельства гово
-
рят о возможных отклонениях в жизнедеятельности
эпителиоцитов СОПР, что делает их более уязвимыми
при травмировании, микробной инвазии и т. п.
Лечение ХРАС
Лечение ХРАС представляет трудную задачу вви
-
ду того, что этиология и патогенез этого заболевания
окончательно не выяснены. Успех лечения обеспечива
-
ет подбор индивидуальной комплексной патогенетиче
-
ской фармакотерапии в соответствии с особенностями
течения процесса и учетом соматического состояния
пациента [20]. Необходимо углубленное обследова
-
ние больного и консультации смежных специалистов,
так как афты на СОПР могут возникать как симптомы
общих заболеваний. Так, они нередко сопутствуют бо
-

44
STOMATOLOGIYA
лезни Крона, язвенному колиту [14], синдрому Рейтерa,
заболеваниям крови [12].
Одним из ведущих направлений в лечении ХРАС яв
-
ляется проведение гипосенсибилизирующей терапии.
При выявлении у больных повышенной чувствительно
-
сти к бактериальному аллергену проводят специфиче
-
скую десенсибилизацию этим аллергеном. В качестве
средств неспецифической десенсибилизации использу
-
ют тиосульфат натрия, гистаглобин, антигистаминные
препараты и препараты кальция [12]. В связи с выяв
-
лением иммунного дисбаланса обосновано включение
в комплексное лечение ХРАС препаратов, обладающих
иммунокорригирующими свойствами [16]: декариса,
Т-активина, даларгина, галавита [44]. По мнению за
-
рубежных авторов [36], профилактическое применение
декариса способствует предотвращению рецидивов бо
-
лезни и нормализации клеточного иммунитета у боль
-
ных ХРАС.
Однако существуют сведения об отсутствии положи
-
тельного результата [19]. Такое противоречие связано,
по-видимому, с двояким его действием: малые дозы
оказывают иммуностимулирующее действие, а боль
-
шие действуют как иммунодепрессанты.
В связи с угнетением местного иммунитета и необхо
-
димостью его коррекции рекомендуется использовать
имудон, гепон, Мипро-ВИТА и полиоксидоний [34].
Для лечения рубцующихся и деформирующих форм
ХРАС применяют кортикостероидные препараты [37].
Для повышения неспецифической реактивности в ком
-
плексе с другими препаратами рекомендуются проди
-
гиозан, пирогенал, лизоцим, пентоксил, метилурацил, а
также аутогемотерапия и плазмаферез [2]. Неотъемле
-
мым компонентом лечения должна быть витаминотера
-
пия. Ведущее место занимают витамин С [43], витами
-
ны группы В [22,41].
В связи с тем, что длительное течение ХРАС со
-
провождается сменой микробиологического статуса,
показано применение эубиотиков местного действия
(ацелак, бифилиз), а также системного действия (Хи
-
лак-форте) [28].
Высокий лечебный эффект наблюдается при при
-
менении препарата на основе кремнийорганического
глицерогидрогеля [21]. Важное место в лечении афтоз
-
ного стоматита занимает диета: больным запрещается
употребление острой, пряной, грубой пищи, спиртных
напитков, курение [31].
В настоящее время происходит стремительное вне
-
дрение гомеопатии в медицинскую практику. Наиболее
широко для лечения ХРАС используется комплексный
гомеопатический препарат Траумель С, который стиму
-
лирует обмен веществ [1]. Несмотря на огромную зна
-
чимость системной терапии, большое внимание долж
-
но быть уделено местному лечению [28].
В комплекс лечебных мероприятий ХРАС целесо
-
образно включать физиотерапию (дарсонвализацию,
УФО, ГБО-терапию), которая направлена на активацию
адаптивных и резервных возможностей организма [18].
Таким образом, проблема этиологии и патогенеза
ХРАС остается открытой. Проанализированные имму
-
нологические изменения при ХРАС отображают в це
-
лом традиционную динамику реализации мукозального
клеточно-опосредованного иммунного ответа, во мно
-
гом являются реактивными для афт, недостаточно обо
-
снованы как этиологически значимые, поэтому влияние
на иммунитет на системном уровне при данном забо
-
левании не вполне оправдано и, как показал обзор, об
-
ладает относительной эффективностью. ХРАС в насто
-
ящее время представляет собой важную медицинскую
и социальную проблему. На современном этапе суще
-
ствует большое количество средств и методов лечения
ХРАС, однако полный алгоритм комплексной терапии
не разработан, отсутствуют методики поддерживаю
-
щей терапии, что требует дальнейших исследований.
Список литературы
1. Кайдашев И.П., Шинкевич В.И., Король Д.М. и др.
Очерки иммунобиологии слизистой оболочки по
-
лости рта; Под ред. И.П. Кайдашева. – Полтава:
Полимет, 2008. – 306 с.33
2. Протокол надання медичної допомоги. Стомато
-
логія. – Київ: МНІАЦ медичної статистики МВЦ
«Медінформ». – 2007. – 236 с.2
3. Рабинович И.М., Рабинович О.Ф. Опыт клиниче
-
ского применения препарата Имудон при лечении
заболеваний слизистой оболочки полости рта //
Стоматология для всех. – 2000. – №3. – С. 10.48
4. Ткаченко П.І., Лохматова Н.М., Шинкевич В.І.,
Кайдашев І.П. Клініко-імунологічне обґрунтування
диференційованого підходу до лікування хронічно
-
го генералізованого катарального гінгівіту в дітей
// Вісник стоматології. – 2004. – №3. – С. 82-87.49
5. Albanidou-Farmaki E., Poulopoulos A.K., Epivatia
-
nos A. et al. Increased anxiety level and high salivary
and serum cortisol concentrations in patients with re
-
current aphthous stomatitis // Tohoku J. Exp. Med. –
2008. – Vol. 214. – P. 291-296.20
6. Albanodou-Farmaki E., Markopoulos A.K., Kaloger
-
akou F., Antoniades D.Z. Detection, enumeration and
characterization of T helper cells secreting type 1 and
type 2 citokines in patients with recurrent aphthous
stomatitis // Tohoku J. Exp. Med. – 2007. – Vol. 212,
№2. – P. 101-105.31
7. Aminoff M., Carter J.E., Chadwick R.B. et al. Muta
-
tions in CUBN, encoding the intrinsic factor-vitamin
B12 receptor, cubilin, cause hereditary megaloblastic
anaemia 1 // Nat. Genet. – 1999. – Vol. 21, №3. – P.
309-313.14
8. Bagg J., Williams B.D., Amos N.et al. Absence of cir
-
culating IgG immune complexes in minor recurrent
aphthous ulceration // J. Oral Pathol. – 1987. – Vol.
16, №2. – P. 53-56.38
9. Barnadas M.A., Remacha A., Condomines J., de Mor
-
agas J.M. Hematologic deficiencies in patients with

45
ОБЗОРНЫЕ СТАТЬИ
recurrent oral aphthae // Med. Clin. (Barc). – 1997.
– Vol. 109, №3. – P. 85-87.7
10. Ben-Aryeh H., Malberger E., Gutman D. et al. Sal
-
ivary IgA and serum IgG and IgA in recurrent aph
-
thous stomatitis // Oral Surg. Oral Med. Oral Pathol.
– 1976. – Vol. 42, №6. – P. 746-752.36
11. Bouchlaka C., Maktouf C., Mahjoub B. et al. Genet
-
ic heterogeneity of megaloblastic anaemia type 1 in
Tunisian patients // J. Hum. Genet. – 2007. – Vol. 52,
№3. – P. 262-270.15
12. Brailo V., Boras V.V., Cekic-Arambasin A. Recurrent
aphthous ulcerations: analysis of predisposing factors
in 68 patients // Lijec. Vjesn. – 2007. – Vol. 129, №1–
2. – P. 4-7.3
13. Buno I.J., Huff J.C., Weston W.L. et al. Elevated Levels
of Interferon Gamma, Tumor Necrosis Factor, Inter
-
leukins 2, 4, and 5, but Not Interleukin 10, Are Present
in Recurrent Aphthous Stomatitis // Arch. Dermatol.
– 1998. – Vol. 134. – P. 827-831.28
14. Burgan S.Z., Sawair F.A., Amarin Z.O. Hematologic
status in patients with recurrent aphthous stomatitis
in Jordan // Saudi Med. J. – 2006. – Vol. 27, №3. – P.
381-384.6
15. Fedosov S.N., Fedosova N.U., Berglund L. et al. Com
-
posite organization of the cobalamin binding and
cubilin recognition sites of intrinsic factor // Biochem
-
istry. – 2005. – Vol. 44, №9. – P. 3604-3614.16
16. Fortune F., Walker J., Lehner T. The expression of gd
T cell receptor and the prevalence of primed, activated
and IgA-bound T cells in Behcet’s syndrome // Clin.
Exp. Immunol. – 1990. – Vol. 82. – P. 326-332.34
17. Freysdottir J., Lau S.-H., Fortune F. T cells in Behcet’s
disease (BD) and recurrent aphthous stomatitis (RAS)
// Clin. Exp. Immunol. – 1999. – Vol. 118. – P. 451-
457.35
18. Garcia Jimenez M.C., Baldellou Vazquez A., Calvo
Martin M.T. et al Hereditary juvenile cobalamin de
-
ficiency due to mutations in GIF gene // An. Pediatr.
(Barc). – 2008. – Vol. 69, №1. – P. 56-58.12
19. Hayrinen-Immonen R. Immune activation in recurrent
oral ulcers (ROU) // Scand. J. Dent. Res. – 1992. –
Vol. 100. – P. 222-227.25
20. Karaca S., Seyhan M., Senol M. et al. The effect of
gastric Helicobacter pylori eradication on recurrent
aphthous stomatitis // Int. J. Dermatol. – 2008. – Vol.
47, №6. – P. 615-617.4
21. Koybasi S., Parlak A.H., Serin E. et al. Recurrent aph
-
thous stomatitis: investigation of possible etiologic
factors // Amer. J. Otolaryngol. – 2006. – Vol. 27, №4.
– P. 229-232.11
22. Kozyraki R., Gofflot F. Multiligand endocytosis and
congenital defects: roles of cubilin, megalin and am
-
nionless // Curr. Pharm. Des. – 2007. – Vol. 13, №29.
– P. 3038-3046.17
23. Lee J.H., Jung J.Y., Bang D. The efficacy of topical
0.2 % hyaluronic acid gel on recurrent oral ulcers:
comparison between recurrent aphthous ulcers and
the oral ulcers of Behcet’s disease // J. Europ. Acad.
Dermatol. Venereol. – 2008. – Vol. 22, №5. – P. 590-
595.47
24. Lewkowicz N., Lewkowicz P., Banasik M. et al. Pre
-
dominance of Type 1 cytokines and decreased number
of CD4(+)CD25(+high) T regulatory cells in periph
-
eral blood of patients with recurrent aphthous ulcer
-
ations // Immunol. Lett. – 2005. – Vol. 99, №1. – P.
57-62.29
25. Lewkowicz N., Lewkowicz P., Dzitko K. et al. Dys
-
function of CD4(+)CD25(high) T regulatory cells in
patients with recurrent aphthous stomatitis // J. Oral
Pathol. Med. – 2008. – Vol. 3. – P. 88-94.30
26. Marchini L., Campos M.S., Silva A.M. et al. Bacterial
diversity in aphthous ulcers // Oral Microbiol. Immu
-
nol. – 2007. – Vol. 22, №4. – P. 225-231.19
27. Martinez K.O., Mendes L.L., Alves J.B. Secretory A
immunoglobulin, total proteins and salivary flow in
Recurrent Aphthous Ulceration // Rev. Bras. Otorino
-
laringol. – 2007. – Vol. 73, №3. – P. 323-328.37
28. Masalha R., Rudoy I., Volkov I. et al. Symptomatic di
-
etary vitamin B12 deficiency in a nonvegetarian pop
-
ulation // Amer. J. Med. – 2002. – Vol. 112. – P. 413-
416.9
29. Matsuda T., Ohno S., Hirohata S.et al. Efficacy of re
-
bamipide as adjunctive therapy in the treatment of re
-
current oral aphthous ulcers in patients with Behcet’s
disease: a randomised, double-blind, placebo-con
-
trolled study // Drugs R D. – 2003. – Vol. 4, №1. – P.
19-28.46
30. McCullough M.J., Abdel-Hafeth S., Scully C. Recur
-
rent aphthous stomatitis revisited; clinical features,
associations, and new association with infant feeding
practices? // J. Oral Pathol. Med. – 2007. – Vol. 36,
№10. – P. 615-620.1
31. Morris M.C., Evans D.A., Bienias J.L. et al. Dietary
folate and vitamin B12 intake and cognitive decline
among community-dwelling older persons // Arch.
Neurol. – 2005. – Vol. 62. – P. 641-645.18
32. Natah S., Haytinen-Immoren R., Heitanen J. et al.
Immunolocalization of tumour necrosis factor-alpha
expressing cells in recurrent aphthous ulsers lesions
(RAU) // J. Oral. Pathol. Mеd. – 2000. – Vol. 29. – P.
19-25.39
33. Pedersen A., Ryder L.P. T-cell fraction of peripheral
blood is increased in recurrent aphthous ulceration //
Clin. Immunol. Immunopathol. – 1994. – Vol. 72. – P.
98-104.32
34. Piskin S., Sayan C., Durukan N., Senol M. Serum iron,
ferritin, folic acid, and vitamin B12 levels in recurrent
aphthous stomatitis // J. Europ. Acad. Dermatol. Vene
-
reol. – 2002. – Vol. 16, №1. – P. 66-67.5
35. Poulter L.W., Lehner T. Immunohistology of oral le
-
sions from patients with recurrent oral ulcers and Be
-
hcet’s syndrome // Clin. Exp. Immunol. – 1989. – Vol.
78. – P. 189-195.24

46
STOMATOLOGIYA
36. Savage N.W., Mahanonda R., Seymour G.J. et al.
The proportion of suppressor-inducer T-lymphocytes
is reduced in recurrent aphthous stomatitis // J. Oral
Pathol. – 1988. – Vol. 17. – P. 293-297.22
37. Scully C., Gorsky M., Lozada-Nur F. The diagnosis
and management of recurrent aphthous stomatitis: a
consensus approach // J. Amer. Dent. Assoc. – 2003. –
Vol. 134, №2. – P. 200-207.10
38. Seder R.A. Acquisition of lymphokine-producing phe
-
notype by CD4+ T cells // J. Allergy Clin. Immunol.
– 1994. – Vol. 94. – P. 1195-1202.27
39. Sharma N.L., Sharma V.C., Mahajan V.K. et al. Tha
-
lidomide: an experience in therapeutic outcome and
adverse reactions // J. Dermatolog. Treat. – 2007. –
Vol. 18, №6. – P. 335-340.42
40. Stenman G., Heyden G. Premonitory stages of recur
-
rent aphthous stomatitis, I: histological and enzyme
histochemical investigations // J. Oral Pathol. – 1980.
– Vol. 9. – P. 155-162.23
41. Sun A., Chia J.S., Wang W.B., Chia C.P. «Tien-Hsien
liquid» can modulate antigen-stimulated cytokine
production by T-cells isolated from patients with re
-
current aphthous ulcerations // Amer. J. Chin. Med.
– 2005. – Vol. 33, №4. – P. 559-571.43
42. Sun A., Chu C.T., Liu B.Y. et al. Expression of interleu
-
kin-2 receptor by activated peripheral blood lympho
-
cytes upregulated by the plasma level of interleukin-2
in patients with recurrent aphthous ulcers // Proc.
Natl. Sci Counc. Repub. China B. – 2000. – Vol. 24,
№3. – P. 116-122.21
43. Tanner S.M., Li Z., Bisson R. et al. Genetically hetero
-
geneous selective intestinal malabsorption of vitamin
B12: founder effects, consanguinity, and high clinical
awareness explain aggregations in Scandinavia and
the Middle East // Hum. Mutat. – 2004. – Vol. 23, №4.
– P. 327-333.13
44. Thornhill M.H., Baccaglini L., Theaker E., Pember
-
ton M.N. A Randomized, Double-blind, Placebo-Con
-
trolled Trial of Pentoxifylline for the Treatment of
Recurrent Aphthous Stomatitis // Arch. Dermatol. –
2007. – Vol. 143, №4. – P. 463-470.41
45. Woodside D.G., Vanderslice P. Cell adhesion antag
-
onists: therapeutic potential in asthma and chronic
obstructive pulmonary disease // BioDrugs. – 2008.
– Vol. 22, №2. – P. 85-100.45
46. Wray D., Graykowski E.A., Notkins A.L. Role of muco
-
sal injury in initiating recurrent aphthous stomatitis //
Brit. Med. J. (Clin. Res. Ed.). – 1981. – Vol. 283. – P.
1569-1570.26
47. Yasui K., Kobayashi N., Yamazaki T., Agematsu K.
Thalidomide as an immunotherapeutic agent: the ef
-
fects on neutrophil-mediated inflammation // Curr.
Pharm. Des. – 2005. – Vol. 11. – P. 395-401.40
48. Zribi H., Crickx B., Descamps V. Prevention of recur
-
rent aphthous stomatitis by efalizumab (Raptiva) // J.
Europ. Acad. Dermatol. Venereol. – 2007. – Vol. 21,
№9. – P. 1286-1287.44
УДК: 616.31:616.33-008.17-039:611.392
ВЗАИМОСВЯЗЬ ЗАБОЛЕВАНИЙ
ПОЛОСТИ РТА С ГАСТРО-
ЭЗОФАГЕАЛЬНОЙ
РЕФЛЮКСНОЙ БОЛЕЗНЬЮ
(ОБЗОР ЛИТЕРАТУРЫ)
Саркисян Н.Г., Воложанина В.А.,
Готлиб В.М.
Уральский государственный медицинский университет
Проанализирована
литература, посвященная прояв
-
лениям в полости рта гастроэзофагеальной рефлюкс
-
ной болезни (ГЭРБ). Анализ источников охватывает
большой временной диапазон: с 1989 по 2017 гг. За это
время было накоплено немало знаний о взаимосвязи па
-
тологии нижележащих отделов желудочно-кишечного
тракта с вышестоящими. Кроме того, в обзоре приведе
-
ны данные учёных из России, США, Англии, Украины,
Польши и Японии. Описаны патологические воздей
-
ствия желудочного содержимого на мягкие и твёрдые
ткани полости рта, результаты микробиологических
исследований (посевы, изменение качественного соста
-
ва микрофлоры полости рта), различные химические
характеристики слюны (буферная ёмкость, содержание
ионов металлов, данные рН и пр.), а также побочное
действие лекарственных средств, применяемых при
ГЭРБ, на органы челюстно-лицевой области и др. Все
научные изыскания были структурированы для лучше
-
го понимания внепищеводных проявлений рефлюксной
болезни, в частности, стоматологических и для раз
-
работки профилактических мероприятий по борьбе с
этим заболеванием.
Ключевые слова:
гастроэзофагеальная рефлюксная
болезнь, стоматологический синдром, внепищеводные
проявления.
Annotation
This article provides a review of the literature on the
manifestations in the oral cavity of gastroesophageal reflux
disease (GERD). Analysis of sources covers a large range of
time: from 1989 to 2017. During this time, a lot of knowl
-